Chemiczne latarki/świetliki
Chemiczne źródła światła („chemiczne świetliki”, „chemiczne latarki”) wykorzystują energię uwolnioną podczas utleniania estrów kwasu szczawiowego i fenoli do produkcji światła. Zjawisko to nazywamy chemiluminescencją.
Opis eksperymentu:
W 100 ml ftalanu dimetylu rozpuść 450 mg szczawianu bis(2,4,6-trichlorofenylu) lub szczawianu bis(2,4-dinitrofenylu). Rozpuszczanie przebiega powoli – mieszaninę można ogrzać do 70-80°C.
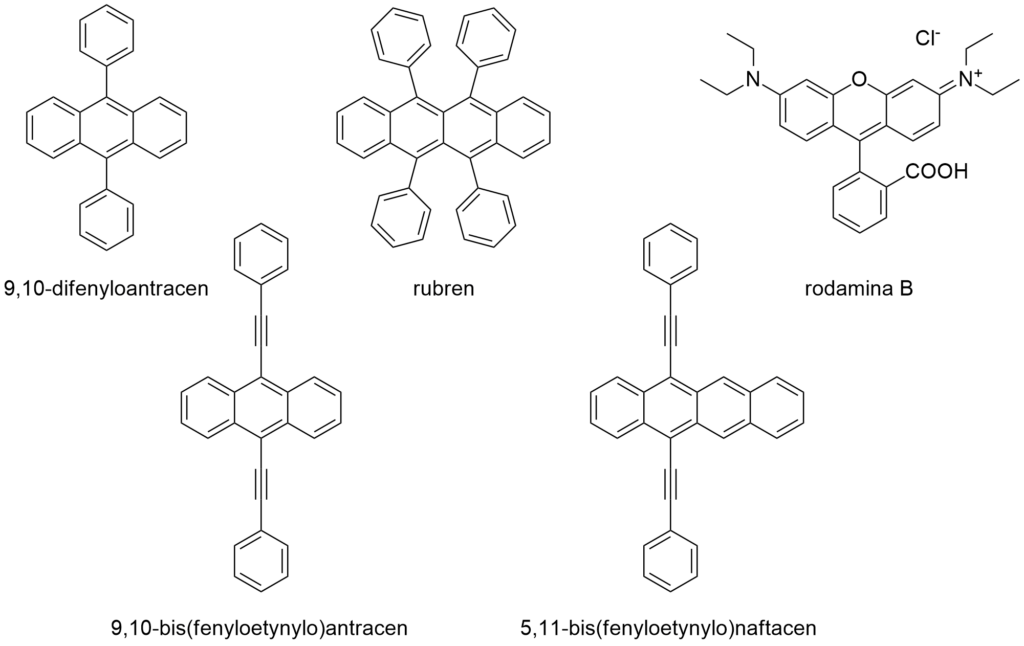
W pięciu małych kolbach stożkowych umieść po około 20 mg sensybilizatorów: rubrenu, 9,10-difenyloantracenu, 9,10-bis(fenyloetynylo)antracenu, 5,12-bis(fenyloetynylo)naftacenu i rodaminy B. Do każdej kolby wlej 20 ml roztworu szczawianu diarylowego we ftalanie dimetylu i mieszaj do rozpuszczenia sensybilizatora.
W osobnym naczyniu przygotuj roztwór utleniacza – mieszaninę 8 ml nadtlenku wodoru (30%) i 20 ml tert-butanolu, a następnie dodaj 80 ml ftalanu dimetylu i dokładnie wymieszaj. Do uzyskanej mieszaniny dodaj około 100 mg salicylanu sodu i ponownie wymieszaj. Powinieneś uzyskać opalizujący roztwór lub trwałą emulsję.
W zaciemnionym pomieszczeniu do przygotowanych kolb zawierających roztwór szczawianu diarylowego i sensybilizatora dodaj po 20 ml roztworu utleniacza. Roztwory wymieszaj. Zaobserwujesz jasną, trwającą od kilku do kilkunastu minut, chemiluminescencję.

Uwaga: Stężony nadtlenek wodoru (30%) uszkadza skórę (powoduje białe, piekące przebarwienia). Pracuj w rękawiczkach. W razie kontaktu z nieosłoniętą skórą spłucz zanieczyszczone miejsce dużą ilością wody. Posiadanie przez osoby prywatne roztworów nadtlenku wodoru o stężeniu >12% jest niezgodne z prawem – eksperyment wykonaj w szkole lub na uczelni!
Wyjaśnienie:
Cząsteczka estru ulega reakcji z nadtlenkiem wodoru. Produktami są fenol (np.: 2,4,6-trichlorofenol) i cykliczny nadtlenek – 1,2-dioksetanodion. Związek ten jest nietrwały i ulega rozpadowi z wytworzeniem dwutlenku węgla. Uwolniona energia jest przekazywana cząsteczce barwnika (sensybilizatora), który ulega wzbudzeniu. Powrotowi cząsteczki sensybilizatora do stanu podstawowego towarzyszy emisja światła.

W zależności od właściwości sensybilizatora, uzyskuje się różną barwę emitowanego światła. Najczęściej stosuje się 9,10-difenyloantracen (jasnoniebieski), 9,10-bis(fenyloetynylo)antracen (jasnozielony), rubren (żółty), 5,11-bis(fenyloetynylo)naftacen (pomarańczowy) i rodaminę B (czerwony).
W komercyjnych chemicznych źródłach światła używa się różne szczawiany. Obok wymienionych, także np.: szczawian difenylu lub szczawian bis(2,4,5-trichloro-6-karbopentoksyfenylowy).
Salicylan sodu pełni funkcję katalizatora zasadowego reakcji rozszczepienia estru przez cząsteczkę nadtlenku wodoru. O innych wariantach eksperymantu ze szczawianami fenoli oraz o ich syntezie napiszemy kiedy indziej:D
Do poczytania dla zainteresowanych:
(i) H.W. Roesky, K. Möckel; Niezwykły świat chemii. Wydawnictwo Adamantan, Warszawa, 1998.
(ii) B.Z. Shakhashiri; Chemical Demonstrations. A Handbook for Teachers of Chemistry, Vol. 1. The University of Wisconsin Press, Madison, 1983.
(iii) M.M. Rauhut, L.J. Bollyky, B.G. Roberts, M. Loy, R.H. Whitman, A.V. Iannotta, A.M. Semsel, R.A. Clarke; Chemiluminescence from reactions of electronegatively substituted aryl oxalates with hydrogen peroxide and fluorescent compounds. J. Am. Chem. Soc., 89(25): 6515-6522, 1967. DOI: 10.1021/ja01001a025
(iv) O. Jilani, T.M. Donahue, M.O. Mitchell; A Greener Chemiluminescence Demonstration. J. Chem. Educ., 88(6): 786-787, 2011. DOI: 10.1021/ed100597n
(v) R. Duarte, J.T. Nielsen, V. Dragojlovic; Synthesis of chemiluminescent esters: a combinatorial synthesis experiment for organic chemistry students. J. Chem. Educ., 81(7): 1010-1015, 2004. DOI: 10.1021/ed081p1010
(vi) A.G. Hadd, D.W. Lehmpuhl, L.R. Kuck, J.W. Birks; Chemiluminescence demonstration illustrating principles of ester hydrolysis reactions. J. Chem. Educ., 76(9): 1237-1240, 1999. DOI: 10.1021/ed076p1237
(vii) M.M. Rauhut, B.G. Roberts, D.R. Maulding, W. Bergmark, R. Coleman;
(viii) K.-D. Gundermann, F. McCapra; Chemiluminescence in organic chemistry. (Reactivity and structure: Concepts in organic chemistry 23), Springer-Verlag, Berlin, 1987.
(ix) G. Orosz; The role of diaryl oxalates in peroxioxalate chemiluminescence. Tetrahedron, 45(11): 3493-3506, 1989. DOI: 10.1016/S0040-4020(01)81028-0
(x) G.A. Souza, A. P. Lang, W. J. Baader; Mechanistic studies on the peroxyoxalate chemiluminescence using sodium salicylate as base catalyst. Photochem. Photobiol., 93(6): 1423-1429, 2017. DOI: 10.1111/php.12797
(xi) W.J. Baader, C.V. Stevani, E.L. Bastos; Chemiluminescence of organic peroxides. [w:] Z. Rappoport (red.) PATAI’S chemistry of functional groups. Peroxides 2. John Wiley & Sons, Chichester, 2006. DOI: 10.1002/9780470682531.pat0362
(xii) P.J.M. Kwakman, G. J. de Jong, U. A. T. Brinkman; Mechanism of the peroxyoxalate chemiluminescence reaction. Tr. Anal. Chem., 11(7): 232–237, 1992. DOI: 10.1016/0165-9936(92)87055-o

Komentarze